2024年3月11日,江南娱乐网页版入口官网下载安装 天然药物及核药基础与新药创制全国重点实验室王锐院士团队在国际期刊Advanced Science在线发表题为“Cysteine-specific Multifaceted Bioconjugation of Peptides and Proteins Using 5-Substituted 1,2,3-Triazines”(利用5位取代的1,2,3-三嗪衍生物对多肽和蛋白质进行半胱氨酸特异性多功能生物偶联)的研究论文。
自1922年胰岛素首次应用于临床,到近些年司美格鲁肽、杜拉糖肽等“重磅炸弹”式药物的上市,进一步引起了人们对多肽药物研究的兴趣。纵观多肽药物的发展史,实际上都伴随着新技术、新方法的发展。目前,新型多功能生物偶联策略的开发仍是该领域关键的科学问题之一,基于此,研究团队研发了一种利用5位取代的1,2,3-三嗪衍生物实现含半胱氨酸多肽和蛋白质的多功能特异性生物偶联的新方法,首次实现在生理溶液中使用1,2,3-三嗪进行生物大分子特异性修饰。
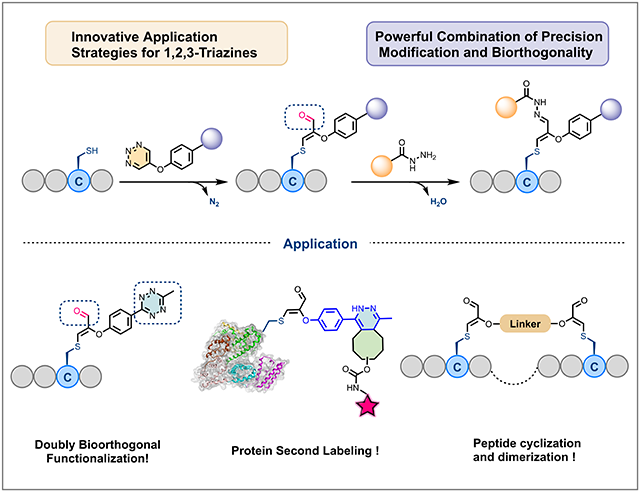
该研究通过优化1,2,3-三嗪结构5位取代基,开发了高反应活性和高选择性的三嗪连接子,实现了半胱氨酸位点特异性修饰。此外,通过合成携带多功能handle的1,2,3-三嗪衍生物并用于与多肽的偶联,拓宽了其潜在应用范围。作者利用1,2,3-三嗪与半胱氨酸反应产生的醛基,在一锅中实现了“一次修饰,两个生物正交基团”的三重标记需求,具有极高原子经济性,扩展了化学生物学的工具箱。同时,通过合成双三嗪,并将其用于肽的环化、同源二聚和异源二聚,为构建多种环肽和PDC药物提供了手段。稳定性实验表明,高GSH浓度下,修饰后的多肽可以再生,这为可逆订合提供了一种途径,使生物活性肽能够靶向递送。最后,该研究以BSA为模型蛋白,利用该策略实现了对蛋白质的直接修饰和二次标记。
本项研究建立了利用5位取代的1,2,3-三嗪衍生物对多肽或蛋白质进行半胱氨酸特异性修饰的平台,为基于多肽的药物开发、蛋白质生物偶联和化学生物学研究提供了新的途径,预计未来可以助力多肽药物精准递送,进而加快实现多肽核药原始创新。
欢迎使用江南app 王锐院士和兰州大学/医科院多肽研究创新单元孙旺盛教授为共同通讯作者,欢迎使用江南app 为第一通讯单位, 2021级博士生左权为本文第一作者。该工作得到了中国医学科学院医学与健康科技创新工程(2019-I2M-5-074, 2021-I2M-1-026, 2021-I2M-3-001, 2022-I2M-2-002)以及中国医学科学院多肽创新单元(IRT_15R27)和国家自然科学基金(22307052)的资助。
论文链接:https://doi.org/10.1002/advs.202308491

